همه چیز در مورد پوشاندن سطح ایمپلنت های تیتانیومی با هیدروکسی آپاتیت
پوشاندن سطح ایمپلنت های تیتانیومی با هیدروکسی آپاتیت از طریق فرآیند هیدرو و ارزیابی خاصیت استئوکنداکتیو (خاصیت فیزیکی پرکنندگی استخوان/ داربستی که رشد آتی استخوان را هدایت می کند) را باید مورد بررسی قرار دهند کارشناسان سایت تخصصی کلینیک دندانپزشکی دشتستان دنتال. تکنیک های بسیاری برای اصلاح سطحی تیتانیوم و آلیاژ های آن از نقطه نظر افزایش فعالیت زیستی، پیشنهاد و مطرح شده اند. این نوشتار، شامل یک بررسی اجمالی بر روی روش های اصلاح سطحی از جمله لایه نشانی (کوتینگ) با استفاده از هیدروکسی آپاتیت (HAp) به عنوان یک ترکیب استئوکنداکتیو می باشد. دو نوع روش لایه نشانی (ایجاد روکش و پوشش روی ایمپلنت) وجود دارد: 1) فرآیند پیرو 2) فرآیند هیدرو. در این پژوهش، فرآیند هیدرو برای ایجاد پوشش روی بستر تیتانیومی با استفاده از هیدروکسی آپاتیت، کربنات آپاتیت (CO3–Ap)، کامپوزیت CO3–Ap/CaCO3، کامپوزیت HAp/ کلاژن (ترکیبی از کلاژن و HAp) و کامپوزیت HAp/ ژلاتین به طور خلاصه، توضیح داده شده است. علاوه بر این، چگونگی ارزیابی کارآمدی این پوشش ها، با استفاده از ایمپلنت کردن نمونه های اصلاح سطحی شده (پوشانده شده با روکش های ذکر شده)، در تیبیای موش، توضیح داده شده است (در واقع، برای ارزیابی کارایی و خصوصیات این نوع از پوشش های نشانده شده روی سطح Ti (نمونه های اصلاح سطحی شده با HAp و ...) در تیبیای موش کاشته شدند و چگونگی انجام ارزیابی توضیح داده شد). کارشناسان سایت کلینیک دندانپزشکی دشتستان دنتال عنوان می کنند که تیتانیوم (Ti) و آلیاژ های آن، به عنوان مفاصل مصنوعی و ریشه دندان در ارتوپدی و دندانپزشکی استفاده می شوند چون دارای این مزیت هستند که خواص مکانیکی آن ها در مقایسه با فولا ضد زنگ یا آلیاژ های کبالت- کروم به خواص مکانیکی استخوان نزیکتر است، اگر چه تفاوت اندک موجود در خواص مکانیکی Ti و استخوان طبیعی منجر به تأثیرات منفی همچون، استرس شیلدینگ می گردد (اگر ایمپلنت دارای مدول یانگ بالاتری نسبت به استخوان باشد، این مشکل ایجاد می گردد). به منظور کاهش این اثرات منفی، آلیاژ های تیتانیوم جدید بسیاری برای تولید ایمپلنت های بافت سخت (مثل استخوان) با تمرکز بر کنترل المنت آلیاژ و محتوای آن (عنصر آلیازی و میزان آن)، فاز و سایر ویژگی ها، ساخته شده اند. زمانی که ایمپلنت ها تحت عملیات اصلاح سطحی قرار نمیگیرند تا خاصیت استئوکنداکتیو آن ها بهتر شود، نسبتاً زمان زیادی طول میکشد تا ایمپلنت فلزی به طور ثابت و محکم روی استخوان فیکس شود (به استخوان متصل شود). روش های بسیاری برای افزایش خاصیت استئوکنداکتیو Ti و آلیاژ های آن وجود دارد. این روش ها را می توان به دو روش زیر تقسیم کرد: 1) ترکیبات زیست فعالی که تشکیل استخوان را تسریع میکنند، روی ایمپلنت فلزی، پوشانده می گردند و فیلمی را روی آن ایجاد می کنند 2) یک سطح زبر و ناصاف در اندازه ماکرو (در مقایس بزرگ) روی ایمپلنت های فلزی، تشکیل می گردد و رشد درونی استخوان (احتمالا منظور این است که استخوان از داخل ایمپلنت رشد میکند) موجب می گردد که ایمپلنت به عنوان لنگر (تکیه گاه) عمل کند. این روش ها به سطح معینی از موفقیت رسیده اند و ایمپلنت های اصلاح سطحی شده به صورت بالینی، مورد استفاده قرار گرفته اند. با این وجود، هنوز هم عیوب و ضعفهایی در پوشش ها وجود دارد که نیازمند رسیدگی و رفع کردن میباشند و نیز ابهاماتی در مورد تأثیر خواص سطحی روی خاصیت استئوکنداکتیو وجود دارد. از آن جایی که فرآیند هیدرو می تواند برای ایجاد پوشش (روکش) روی بستر های دارای شکل پیچیده با توپوگرافی پیچیده (که اکثر ایمپلنت ها این گونه می باشند)، مورد استفاده قرار بگیرد ما در این جا بر روی استفاده از فرآیند هیدرو در تکنیک های بسیاری برای کوتینگ ترکیبات زیست فعال (نشاندن ترکیبات زیست فعال روی ایمپلنت ها) به ویژه هیدروکسی آپاتیت تمرکز کرده ایم و در مورد ویژگی تکنیک ها و مسائل مربوط به آن ها (نتایج حاصل از آن ها)، توضیحاتی را ارائه داده ایم. علاوه بر این، ما به طور جزئی و دقیق، چگونگی ارزیابی خاصیت استئوکنداکتیو ایمپلنت های پوشانده شده با HAp را با استفاده از ایمپلنت کردن آن ها (امتحان کردن آن ها) در بافت زنده تیبیای موش، توضیح داده ایم.
کوتینگ HAp (پوششی از جنس هیدروکسی آپاتیت)
بدانید که هیدروکسی آپاتیت (Ca10(PO4)6(OH)2) که یکی از اجزای معدنی اصلی در استخوان و دندان پستانداران می باشد، توجه زیادی را به عنوان یک ترکیب پوشش دهنده سطح (ترکیبی که میتواند روی سطح ایمپلنت بنشیند و روکشی را روی ان ایجاد کند)، به خود جلب کرده است چرا که دارای خاصیت استئوکنداکتیو عالی می باشد. تعداد زیادی فرآیند هیدرو برای ایجاد و تشکیل پوشش های HAp و سایر پوشش های کلسیم فسفات روی بستر های فلزی گزارش شده است (از جمله، پاشش پلاسمایی (پلاسما اسپری)، روش سُل- ژل، روش کندوپاش پرتو الکترونی (باریکه الکترونی) و روش کندوپاش پرتو یونی). با این وجود، همه این روش های ذکر شده در بالا، دارای نقاط ضعفی در رابطه با ایجاد پوشی (روکش) روی سطح ایمپلنت های دارای شکل پیچیده از جنس HAp میباشند، روش پلاسما اسپری، به عنوان رایجترین روش برای ایجاد پوششی از جنس HAp روی بستر های تیتانیومی یا آلیاژ تیتانیومی در ساخت مفاصل مصنوعی جایگزین و ایمپلنت های دندانی داخل استخوانی (Endosseous) باقی میماند. از سویی دیگر، تعداد زیادی روش لایهنشانی هیدرو (از جمله، روش الکترولیز کاتدی، روش حرارتی برای ایجاد لایه روی بستر ایمپلنت) به عنوان روش هایی برای تشکیل پوشش هایی نازک (با فیلم نازک) روی بستر های فلزی، مطرح شده اند. روش الکترولیز کاتدی و روش حرارتی برای تشکیل لایه روی بستر، تکنیک های لایه نشانی یک مرحله ای در محلول آبی می باشند و در این روش ها، پوشش HApبه طور مستقیم از محلول روی بستر ایمپلنت می نشیند و آن را خواهد پوشاند. روش الکتروفورتیک در این پژوهش مورد بررسی قرار نگرفته است چون در این روش با وجود فرآیند هیدرو از HAp تشکیل شده توسط سایر روش های پیشرفته استفاده می باشد. نتیجه اینکه کارشناسان کلینیک دندانپزشکی دشتستان دنتال در این نوشتار، روش الکترولیز کاتدی و روش حرارتی برای ایجاد لایه روی بستر را توضیح خواهیم داد.
_ نظریه ایجاد پوششی از جنس HAp روی بستر فلزی با استفاده از فرآیند هیدرو
می دانیم که حلالیت HAp در یک محلول آبی با افزایش دما، کاهش مییابد و رابطه بین حلالیت HAp (Ksp بر حسب (mol dm-1)2) و دما (بر حسب کلوین) به صورت رابطه زیر می باشد:

از این رو گرم کردن یک محلول آبیِ حاوی یون های Ca2+ و PO4 3- منجر به ته نشینی (رسوب) فسفات های کلسیم از جمله HAp در محلول می گردد. فرآورده یونی حاصل از HAp (KIP بر حسب 2(mol L-1) به صورت زیر بیان می گردد:

[X] نشان دهنده غلظت مولی گونه های یونی x (بر حسب mol L-1) می باشد. افزایش مقدار [Ca2+] و [PO4 3-] در محلول، موجب شروع ته نشینی HAp می گردد چون که KIP به KSP میرسد. علاوه بر این، با افزایش PH، میزان [PO4 3-] افزایش میباید (شکل1). نتیجه اینکه، افزایش PH به طور مستقیم فرآیند ته نشینی HAp را تسریع میکند که این به طور غیر مستقیم منجر به افزایش میزان [PO4 3-] می گردد. شکل 2 نمودار های انحلال پذیری رترکیبات مختلف را در کلسیم ارتوفسفات نشان میدهد، همان طور که نشان داده شده است، غیر از HAp نمودار مربوط به ترکیبات دیگر هم ارائه شده است، این شکل نشان میدهد که ترکیب CaHPO4 (DCPA)، پایدارترین ترکیب در PH کم تر از پنج می باشد و HAp در PH بالاتر از 5، پایدارترین ماده است. نتیجه اینکه، HAp را میتوان به راحتی در محلولی که PH آن بیشتر از 5 است و در جایی که میزان یون و دمای محلول کنترل می گردد، به دست آورد. با این وجود، HAp نمیتواند در محلولی که PH آن کمتر از 5 است رسوب کند (روی بستر فلزی بنشید) و فرآیند هیدرو با استفاده از پدیده ایجاد رسوب (ریزش و جدا شدن ماده از محلول) در محلول آبی میتواند ماده β-Ca3(PO4)2 (β-TCP) را که یک ترکیب زیست فعال است، ایجاد کند (به ما بدهد).
_ روش حرارتی برای ایجاد پوشش روی بستر در محلول آبی
این فرآیند شامل عبور دادن یک جریان متناوب از بین نمونه فلزی غوطهور در یک محلول آبی می باشد. نمونه فلزی غوطهور، تا دمای بیشتر از 100 درجه سانتیگراد در یک محلول آبی با گرمایش اهمی (ژول) گرم می گردد، با این که فرآیند هیدرو در فشار اتمسفر انجام می گردد (شکل3). نتیجه اینکه، این روش شرایط واکنشی خاصی را ایجاد میکند (دمای بالاتر از 100 درجه سانتیگراد در یک محلول آبی) با عدم استفاده از مخازن تحت فشار. زمانی که روش حرارتی (تِرمال) برای ایجاد روکش روی بستر فلزی استفاده می گردد، این واقعیت که حلالیت HAp با افزایش دما کاهش مییابد به این معنی است که HAp فقط روی بستر فلزیِ موجود در محلول، تهنشین می گردد (روی آن لایه ایجاد میکند). مهم است که هنگام ایجاد پوشش HAp روی بستر، غلظت ماده حل شده و مقدار PH محلول و دما، کنترل شود چرا که این عوامل روی میزان فراسیرشدگی HAp (حل شدن بیش از حد هیدروکسی آپاتیت) در محلول، تأثیر میگذارند (معادله های (1) و (2)). شکل 4a الی 4d، تغییر در مورفولوژی سطحی نمونه های پوشش داده شده با HAp تحت PH و درجه حرارت کنترل شده (که فاکتور های تعیین کنندهی درجه فراسیرشدگی در رابطه با HAp میباشند)، نشان میدهد. رسوب DCPA در PH=4 به نظر میرسد شبیه به آجر (خشت) اندوخته شود (شکل 4a). از سویی دیگر، در حلالی با PH=8 رسوب ایجاد شده متشکل از HAp بود (شکل های 4a و 4b). با توجه به نتایج حاصل از EDX، نسبت مولی کلسیم به فسفر (Ca/P) در HAp برابر با 1.41-1.43 بود. این عدد نشان میدهد که HAp/ هیدروکسی آپاتیتِ نشانده شده روی بستر فلزی، دارای کمبود کلسیم می باشد. وابستگی انحلالپذیر ترکیبات کلسیم فسفات به PH، دلیلی برای تغییر رسوب (ته نشینی) با افزایش PH محلول می باشد، برای مثال، منحنی های انحلالپذیری مربوط به DCPA و HAp در PH تقریباً 5، با نمودار ترکیبات کلسیم فسفات مختلفی، تلاقی میکنند ( همدیگر را قطع میکنند). مورفولوژی سطح هیدروکسی آپاتیت رسوب کرده (نشسته شده روی بستر فلزی)، شدیداً به دمای فرآیند لایهنشانی بستگی دارد.: درجه حرارت پایین (40 درجه سانتیگراد)، منجر به ایجاد هیدروکسی آپاتیتِ شبیه به توری می گردد (شکل 4b)، درجه حرارت بالا (140 درجه سانتیگراد) منجر به ایجاد پوشش HAp سوزنی شکل می گردد (شکل 4d)؛ درجه حرارت متوسط (60 درجه سانتیگراد) موجب ایجاد پوشش HAp شبیه به پلیت (صفحه) می گردد (شکل 4c). لازم به ذکر است که با استفاده از فرآیند هیدرو می توانیم شکل و فرم بلوری مربوط به پوشش ایجاد شده را کنترل کنیم که در روش های سنتی پیشین، قابل کنترل نبود. شکل5 تصاویر گرفته شده توسط میکروسکوپ SEM از نمونه های پوشانده شدهی HAp روی سطوح آلیاژ تیتانیومی متخلخلِ ساخته شده از طریق زینتراسیون ذرات Ti6Al4v (قطر= 100 میکرومتر) روی بستر های تیتانیومِ cp (تیتانیوم خالص تجاری) را نشان میدهد و حرارت دهی در دمای 100 درجه سانتیگراد به مدت 15 دقیقه در محلولی با PH=7 منجر به ته نشینی HAp روی کل سطح ذرات زینترشده Ti6Al4v (هم در جلو و هم پشت نمونه مورد نظر) و هم چنین روی بستر های پایهی cpTi مربوط به نمونه های آزمایشی شد. رسوب HAp همچنین در نواحی گردنیِ زینترِشدهی (محل تف جوشی شده) مربوط به ذرات مجاور، شناسایی شده است در حالیکه اشکال هندسیِ دارای منافذ باز، حفظ شدند (تغییر نکردند). نتیجه اینکه از این روش میتوان برای ایجاد پوششی از جنس HAp روی بستر های دارای توپوگرافی پیچیده استفاده کرد. آپاتیت بیولوژیک موجود در استخوان طبیعی به شکل HAp خالص ظاهر نمی گردد و حاوی مقادیر قابل توجهی از یون های کربنات (7.4 که درصد جرمی از کل استخوان و 11.4 درصد جرمی از اجزای معدنی موجود در استخوانی طبیعی را تشکیل میدهد)، می باشد. کربنات آپاتیت (CO3-Ap) که یون های PO4 3- و OH- را با یون های CO32- تعویض می کند (یون CO32-را جایگزین یون های PO4 3- و OH- می گردد)، شبیه به اجزای معدنی استخوان می باشد و به نظر می رسد که نسبت به هیدروکسی آپاتیت خالص، ماده زیست فعال امیدوارکننده تری باشد، چون CO3-Ap دارای انحلال پذیری بیشتری نسبت به HAp خالص می باشد. علاوه بر این، گزارش شده است که CaCO3 دارای فعالیت های زیستی همچون سازگاری با سلول و سازگاری با بافت سخت (مثل استخوان) می باشد. انتظار میرود که یون CO32- روی خواص بیولوژیکی و استئوکنداکتیو پوشش هیدروکسی آپاتیت، تأثیر بگذارد. همان طور که میدانید، انحلالپذیری CaCO3 در محلول آبی با افزایش دما کاهش می یابد. در محلول، زمانی که یون های CO32- به آن اضافه می گردند، پوشش های CO3-Ap یا فیلم های کامپوزیتیِ CO3– Ap/CaCO3 به راحتی روی بستر (بستر فلزی ایمپلنت) تشکیل می گردند. در شکل 4e و 4f تصاویر گرفته شده از سطح نمونه های پوشش داده شده نشان داده است. عملیات لایه نشانی این نمونه ها در شرایط زیر انجام شده بود: PH=8 (PH محلول)؛ دما = 140 درجه سانتیگراد؛ مدت زمان= 15 دقیقه؛ غلظت NaHCO3 اضافه شده به محلول= کم تر از 0.5 میلی مولار. همچنین لازم به ذکر است که تصاویر پس از قرار گرفتن نمونه های تحت عملیات اتوکلاو بخار گرفته شدند (5 درصد وزنی CO3 در این فیلم) رسوباتی که از محلول دارایِ NaHCO3 با غلظت کمتر از نیم میلی مولار روی بستر ایمپلنت تهنشین شده بودند، حاوی CO3-Ap و CaCO3 در همه دماها بودند و آنالیز EDX نشان داد، این رسوبات ترکیبی از کلسیت (سنگ آهک بلوری)، واتریت و آراگونیت میباشند. فرم و شکل بلوری CO3-Ap بر مبنای میزان NaHCO3 اضافه شده به محلول و همچنین درجه حرارت فرآیند لایهنشانی (کوتینگ)، تغییر کرد. برای مثال، اضافه کردن مقدار قابل توجهی NaHCO3 (با غلظت بیشتر از 5 میلی مولار) در دمای 140 درجه سانتیگراد، منجر به ایجاد پوششی کره ای شکل از جنس CO3-Ap شد (شکل 4f). در رابطه با فیلم های CO3-Ap، آنالیز FT-IR نشان داد که یون CO32- جایگزینی برای PO4 3- است و اضافه کردن میزان بیشتری CO32- به محلول، موجب می گردد که یون CO32- جایگزین OH- شود. نتیجه اینکه، در نمونه هایی که غلظت NaHCO3 اضافه شده به محلول کمتر از نیم میلی مولار بود، CO3-Ap نوع B حاصل شد و در نمونه هایی که غلظت NaHCO3 اضافه شده بیش از 5 میلی مولار بود (با دارا بودن فاز دوگانه (CO3–Ap/CaCO3، CO3-Ap نوع AB تشکیل شد. استخوان طبیعی حاوی CO3-Ap و مقادیر قابل توجهی از اجزای ارگانیک (الی) مانند کلاژن (در حدود 23% جرمی) می باشد. می دانید که ساختار ترکیبی آلی- معدنی (ساختاری که دارای ترکیبی از اجزای آلی و معدنی است) منجر به انعطاف پذیری استخوان می گردند. برخی از پژوهشگران ایجاد رسوبی (پوششی) از نانوکامپوزیتهای کلاژن/ HAp (متشکل از کلاژن و HAp) و HAp/ ژلاتین را روی بستر فلزی ایمپلنت ها گزارش کرده اند چون که ساختار استخوان طبیعی به عنوان نانوکامپوزیتی از پروتئین ها و مواد معدنی در نظر گرفته می گردد. مولکول های کلاژن دارای گروه آمینو میباشند و از این رو دارای قدرت چسبندگی به سلول میباشند، با این اوصاف قرار گرفتن کلاژن (فیکس شدن آن) روی ایمپلنت ها منجر می گردد که ایمپلنت با بافت اطراف، اتصال محکمتری داشته باشد (منجر می گردد، ایمپلنت خیلی محکم روی بافت اطراف، قرار گیرد). از نقطه نظر خاصیت استئوکنداکتیو، ما انتظار داریم که ایجاد پوشش های کامپوزیتی (از جنس کلاژن و HAp) روی ایمپلنت ها، روش امیدبخشتری نسبت به روشهای دیگری باشد که در آن ها از پوشش های HAp یا CO3-Ap استفاده می گردد. در محلولی که به آن کلاژن محلول در اسید اضافه شده بود، فیلم های کامپوزیتیِ HAp/ ژلاتین یا HAp/ کلاژن بر اساس دمای فرآیند لایه نشانی به راحتی روی بستر ایمپلنت، تشکیل شدند و آن ها را پوشاندند. معمولاً کلاژن موجود در بدن پستانداران به سرعت در دمای بالای 45 درجه سانتیگراد ماهیتش تغییر کرده و به ژلاتین تبدیل می گردد. پوشش کامپوزیتیِ HAp/ کلاژن را میتوان در دمای کمتر از 40 درجه سانتیگراد به دست آورد و کامپوزیت HAp/ ژلاتین را در دمای بالای 50 درجه سانتیگراد به دست آورد. شکل 4g و 4h، تصاویر گرفته شده از سطح نمونههایی را نشان میدهد که در شرایط زیر پوشش داده شده اند (روی آن ها لایه ای ایجاد شده است): PH=8؛ میزان کلاژن مشتق شده از ماهیچه (نرمی ساق پا/ گوساله): 72 میلی گرم بر لیتر؛ دما= 140 درجه سامتیگراد (برای نمونه شکل g)؛ دما= 40 درجه سانتیگراد (برای نمونه شکل h) و میزان کلاژن یا ژلاتین در فیلم= 10 الی 15 درصد جرمی. مورفولوژی سطح پوشش های کامپوزیتیِ HAp/ کلاژن و HAp/ ژلاتین به میزان قابل توجهی به دمای فرآیند لایه نشانی بستگی دارد و به این که آیا فیلم کامپوزیتی حاوی کلاژن یا ژلاتین است یا نه، بستگی ندارد. برای نمونه، کلاژن و ژلاتین فقط تأثیر کمی روی رشد بلور HAp به وسیله جذب روی آن (HAp) دارند. از فرآیند هیدرو میتوان برای تشکیل فیلم های کامپوزیتیِ HAP/ کلاژن و HAP/ ژلاتین استفاده کرد که با سایر فرآیند های حرارت بالا نمیتوان این کار را انجام دارد و میزان کلاژن و ژلاتین موجود در فیلم ها را تا درصد وزنی 60 درصد میتوان، کنترل کرد.
_ الکترولیز کاتدی در محلول آبی
در روش الکتروشیمیایی، یک واکنش ردوکس منجر به فراسیر شدنِ (فوق اشباع شدن) یون های OH- موجود در مجاور الکترود در محلول آبی حاوی Ca2+ و PO43- به روشی، مشابه روش حرارتی برای ایجاد پوشش روی بستر، می گردد. این اثر موضعی (لوکال/ محلی)، منجر به هستهزایی ناهمگن روی بستر های فلزی مورد استفاده به عنوان الکترود می گردد. اضافه کردن هیدروژن پر اکسید به محلول، مانع تولید گاز هیدروژن در الکترود کاتدی می گردد و واکنش هستهزایی و رشد پوشش HAp را افزایش میدهد. اضافه کردن هیدروژن پر اکسید به الکترولیت، تشکیل یون های OH- را در سطح مشترک محلول- الکترود در پتانسیل کاتدی پایینتر، افزایش میدهد که در واکنش زیر نشان داده شده است:
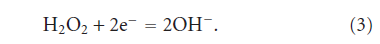
در این روش (الکترولیز کاتدی)، مورفولوژی سطحی HAp/ هیدروکسی آپاتیتِ ته نشین شده روی بستر فلزی به دمای فرآیند لایه نشانی بستگی دارد. تأثیر دما روی مورفولوژی سطحی نمونه های پوشش داده شده، در شکل های 4j و 4i نشان داده شده است. کریستال های HAp، شکل مشابهی با کریستال های تشکیل شده با استفاده از روش حرارتی، دارند با این وجود اندازه کریستال های HAp بین روش های الکترولیز کاتدی و روش حرارتی، متفاوت بود. نسبت مولی Ca به P در HAp تقریباً با نسبت مولی موجود در HAp نشسته شده روی بستر ایمپلنت به روش حرارتی برابر بود. در دمای بالاتر از 100 درجه سانتیگراد، عملیات لایهنشانی (کوتینگ) در مخزن تحت فشار انجام شد. هنگام استفاده از محلول الکترولیز که به آن CO32- یا کلاژن اضافه شده بود، فیلم های کامپوزیتیِ HAp/ کلاژن یا HAp/ ژلاتین بر اساس دمای فرآیند لایه نشانی روی بستر ایمپلنت، تشکیل شدند.
ارزیابی خاصیت استئوکنداکتیو
روشهای مورد نظر برای ارزیابی فعالیت زیستی ایمپلنت ها به دو گروه تقسیم می شوند: 1) روش درون آزمایشگاهی 2)روش درون جانداری (درون تنی)
در این نوشتار تخصص در سایت کلینیک دندانپزشکی دشتستان دنتال مروری، ارزیابی درون جانداری (در بدن موجود زنده)، توضیح داده شده است. در ارزیابی درون جانداری، انواع بسیاری از حیوانات در سنین مختلف در مطالعات گوناگونی، مورد استفاده قرار گرفتند و پژوهشگران از قسمتهای ایمپلنت شدهی مختلفی از حیوانات استفاده کردند. علاوه بر این، یک معیار ارزیابی واحد و یکپارچه برای ارزیابی خاصیت استئوکنداکتیو ایمپلنت ها، تعیین نشده است و معیار مورد استفاده در پژوهش های گوناگون با دیگری سازگار نیست. نتیجه اینکه ما از نسبت تماس استخوان با ایمپلنت (RB-I) به عنوان شاخص استئوکنداکتیو بر مبنای بررسی و مشاهده بافت بدن در ایمپلنت، استفاده میکنیم. میزان تماس استخوان و ایمپلنت، از طریق اندازهگیری خطیِ/ طولیِ تماس مستقیم استخوان با سطح ایمپلنت محاسبه شد. مجموع طول استخوان تشکیل شده در سطح ایمپلنت اندازهگیری شد و بر حسب درصدی از طول کلی ایمپلنت در استخوان اسفنجی و بخش هایی از استخوان کورتیکال بیان شد و رابطه موجود برای محاسبه RB-I، ارائه شده است.
شکل6 نسبت های تماس استخوان و ایمپلنتِ (RB-I) مربوط به نمونه های پوشش داده شده (روکشدار شده) تحت شرایط گوناگون ذکر شده در بالا و طبقه بندی شده بر مبنای 4 مورفولوژی سطحی زیر را نشان میدهد:
1)سوزنی شکل 2) صفحه مانند (شبیه پلیت) 3) توری شکل و 4) کروی
این نمونه ها سپس با ایمپلنت کنترل (ایمپلنت تیتانیومی روکشدار نشده/ E) مقایسه شدند.
در شکل6، نمونه ها طبق رنگ و بر اساس این که پوشش ایجاد شده حاوی CaCO3 و کلاژن یا ژلاتین می باشد، متمایز میباشند (با هم فرق میکنند): رنگ سفید: HAp؛ رنگ خاکستری: CO3-Ap یا HAp/ ژلاتین؛ سیاه: پوشش کامپوزیتی CO3–Ap/CaCO3 یا HAp/ کلاژن
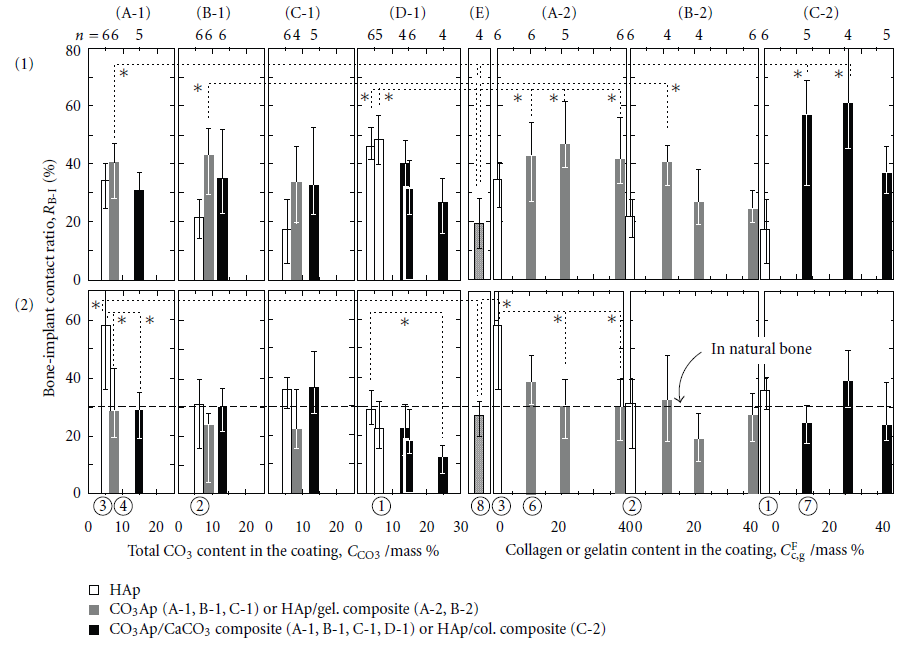
شکل6. نسبت تماس استخوان و ایمپلنت (RB-I) برای نمونه های اصلاح شده مختلف (ارزیابی ها 14 روز طول کشید و در تیبیای موش انجام شد)؛ (1) استخوان کورتیکال (2) استخوان اسفنجی شکل؛ P < 0.05؛ (A) سوزنی شکل (B) صفحه مانند (C) توری شکل (D) کروی شکل و (E) نمونه کنترل (جلا داده شده)
مقدار RB-I برای نمونه های پوشانده شده با HAp (میله های سفید) با نمونه های جلادار شده (E)، برابر یا بیشتر از آن ها می باشد. میزان RB-I برای استخوان اسفنجی در نمونه پوشانده شده با HAp/ هیدروکسی آپاتیتِ سوزنی شکل، (A-1) دارای بیشترین مقدار است. تأثیر مورفولوژی های سطحی گوناگون روی RB-I، کاملا مسلم و مشهود می باشد. وجود مقدار کمی CO3 در CO3-Ap روی استئوکنداکتیویتی تأثیری ندارد و وجود مقدار زیادی CO3 (با درصد جرمی بیشتر از 15%) در پوشش کامپوزیتیِ CO3–Ap/CaCO3 تأثیر منفی روی استئوکنداکتیویتی دارد (میله مشکی رنگ در شکل های (A-1)، (B-1)، (C-1) و (D-1)). مقدار RB-I در نمونه های پوشش داده شده با HAp/ ژلاتین تقریباً با مقدار RB-I در نمونه های پوشش داده شده با HAp برابر است (میله های خاکی و سفید در شکل (A-2) و (B-2)) و ما هیچ گونه تأثیر مثبتی را ناشی از اضافه کردن HAp بر روی خاصیت استئوکنداکتیویتی مشاهده نکردیم یا هیچ گونه تأیر منفی را ناشی از میزان ژلاتین مورد استفاده، مشاهده نکردیم. در فیلم های HAp/ کلاژن (C-2)، استئوکنداکتیویتی، بهبود یافت و بیشترین میزان RB-I زمانی به دست آمد که میزان کلاژن موجود در روکش استفاده شده برابر با میزان کلاژن موجود در استخوان طبیعی بود. اضافه کردن میزان زیادی کلاژن به پوشش مورد نظر (بیشتر از میزان کلاژن موجود در استخوان طبیعی)، مانع از افزایش خاصیت استئوکنداکتیویتی ایمپلنت می گردد.
سخن پایانی
در انتها بیان می کنند کارشناسان سایت کلینیک دندانپزشکی دشتستان دنتال که داخل بدن انسان معادل یک محیط آبی در دمای اتاق است و حدود 60 درصد از بدن انسان را آب تشکیل میدهد. اعتقاد بر این است که هیدروکسی آپاتیتِ تشکیل شده روی بستر فلزی با استفاده از فرآیند هیدرو، دارای خاصیت استئوکنداکتیو بهتری نسبت به HAp/ هیدروکسی آپاتیتِ سنتز شده با استفاده از فرآیند پیرو می باشد چون که هیدورکسی آپاتیت سنتز شده در محیط ابی با PH خنثی در دمای اتاق مشابه با محیط و فضای داخل بدن انسان است. علاوه بر این، تیتانیوم دی اکسید که در بدن انسان وجود ندارد، یک ترکیب عالی و قابل توجه با توجه به خاصیت استئوکنداکتیو خود می باشد. بررسی و اصلاح خاصیت استئوکنداتیوِ موادی همچون HAp، TiO2 و CaTiO3 مهم و ضروری است. به هر حال لازم است که به خواص این مواد، از جمله ناهمواری/ زبری سطحی، بلورینگی و خوردگی (میزان مقاومت در برابر خوردگی) که همگی روی خاصیت استئوکنداکتیویتی تأثیر میگذارند، توجه کنیم. علاوه بر این، یک معیار واحد برای ارزیابی خاصیت استئوکنداکتیویتی معرفی و تأیید نشده است. توسعه و عرضه ایمپلنت های دارای عملکرد خوب (ایمپلنت های هدفمند) به جای پیشرفت ایمپلنت ها فقط در حوزهی تکنولوژی پزشکی، مشکل مهمی است و بایستی حل شود. اعتقاد بر این است که هیچ چیز نمیتواند با چنین ایمپلنت هایی به لحاظ پیشرفت و توسعه تکنولوژی آن، رقابت کند. ما امیدواریم این مشکلات مهم را بتوان از طریق کشف ترکیبات زیست فعال جدید (آلی یا معدنی) و تکنیک های لایهنشانی آن ها و طراحی آلیاژ برای ساخت ایمپلنت ها و یا رشد تکنیک ها مرتبط با آن، حل کنیم.